考试将至,带你梳理那些重要的IB化学考点
来源:A加未来 时间:2020-03-06 15:48
2020年5月IB考试已经临近,为了帮助同学们做好IB化学考试的备考工作,A加未来小编将在本文中为大家整理了IB化学考试内容以及一些重要的IB化学考点,希望对大家有所帮助。IB化学是IB课程里比较热门的科目,分为IB化学高级课程(HL)和IB化学标准课程(SL),学生可以根据自己的程度选择不同级别的课程,IB化学最终笔试占分36%,实验报告和论文占分24%。IB化学的考试的形式如下:
IB化学SL
卷1:45分钟,30道选择题
卷2:75分钟,A部分必答,B部分选答2题
卷3:60分钟,7道题里选答2题
IB化学HL
卷1:60分钟,40道选择题
卷2:135分钟,A部分必答,B部分选答2题
卷3:75分钟,7道题里选答2题
从课程设置来看,IB化学的核心课程有化学计量、原子结构、周期性、化学键与结构、热化学、化学动力学、化学平衡、酸与碱、氧化还原反应、有机化学、测量和数据处理等。
IB化学的HL高级课程难度会比SL标准课程更难,除此之外学生还可以选修材料化学、生物化学、医药化学等章节板块。
IB化学考点——配平化学方程式
所有的化学方程式都可以用所谓“待定系数法”来配平,先设出化学方程式中某些物质的化学计量数,然后根据原子守恒求出未知数的值,最后根据IB化学题目要求标注物质状态。IB化学这一类题目需要注意原子的去向和系数的关系。
对于一个未配平的化学方程式:C2H7N+O2→CO2+H2O+N2
1.先设C2H7N的系数为x,O2系数为y
2.则根据原子守恒有:xC2H7N+yO2→2xCO2+3.5xH2O+0.5xN2
3.由此可以得到:y=3.75x,最简整数比为x:y=4:15
4.因此完整的化学方程式为4C2H7N+15O2→8CO2+14H2O+2N2
5.最后标注物质状态4C2H7N(g)+15O2(g)→8CO2(g)+14H2O(l)+2N2(g)
IB化学考点——摩尔的概念
IB化学中的摩尔缩写为mol,是化学中物质的量的单位。1摩尔是精确包含6.02214076×10²³个原子或分子等基本单元的系统的物质的量,该数值被成为阿伏伽德罗常数(Avogadro constant),通常用L或NA表示。
化学摩尔质量用M表示,指1mol某种物质的质量,其化学数值与该物质的相对分子质量或相对原子质量相等单位是g/mol。
IB化学摩尔的知识点本身并不会很难,主要还是要理清楚摩尔数(n)、离子数(N)和质量(m)的换算关系,他们之间的乘除法不要弄反了,牢记各个单位的概念和关系。
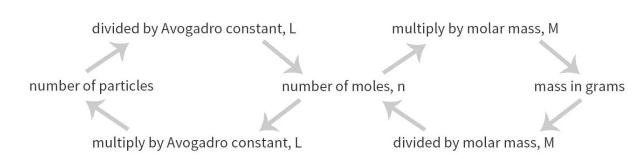
IB化学复习要点——确定实验式
IB化学实验式是用元素符号表示的化合物分子中各元素个数比的最简关系式,IB化学物质的实验式与其分子式不一定相同,但分子式中各个原子的系数一定是实验式的整数倍。确定实验式的IB化学题目一般来说不复杂,解答过程也可以使用计算器。
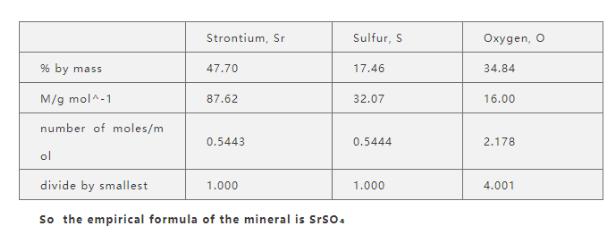
一般来说IB化学题目都是通过实验给出的各元素质量比求实验式。
1、根据IB化学题目提供的元素质量计算该元素的摩尔数,即已知m求n:n=m/M。
2、计算出IB化学题目中所有元素的摩尔数,将他们之间的数量关系化为比例关系。
3、将计算出的比例约化为最简整数比,即得出实验式中各原子的数量比。
IB化学考点——计算反应式的质量和体积
根据IB化学题目中参与反应的部分质量换算出其他物质的质量,这类IB化学题目多为问答题。

1、IB化学题目中反应式的各个物质摩尔比即是他们在方程式中各自的系数比。
2、根据IB化学各个物质的摩尔比计算质量比,即由n求m,m=nM。
3、根据IB化学题目提供的某种物质的质量结合反应式中的质量比计算目标物质的质量。
IB化学考点——限量试剂
IB化学的限量试剂的题目会有一定难度。在IB化学的一些计算生成物产量的题目中会给出多个反应物的质量,但质量不一定刚好满足IB化学方程式中的系数比。我们需要通过计算IB化学题目的摩尔数来判断哪个是限量试剂,以他为有效数据来计算生成物产量或产率。

1、根据提供的IB化学反应物质量计算摩尔数
2、计算IB化学反应物的摩尔比
3、比较IB化学题目给定的摩尔比与方程式中的摩尔比,相对最小的即为限量试剂
4、以限量试剂计算生成物产量
IB化学考前复习策略
1、考前先把所有之前做过的IB化学错题复习一遍,总结错的比较多的章节。有基本概念不清楚的一定要回归课本弄清楚为止。
2、IB化学一定要掌握各个公式和数据表格的使用,针对不熟悉的公式要多练习相应题目。
3、IB化学如果有简单的易错点,比如倍数关系的遗漏,需要单独总结相应场景多加练习。
以上就是A加未来小编关于IB化学考点以及备考方法建议的分享,相信做好这些考点内容的准备对你未来考试一定能起到不少的帮助。如果在学习上还有什么疑问,欢迎随时咨询A加线上老师,让老师一对一为你答疑解惑吧!

